肝腫瘤治療又增添一項利器,健保署自2020年12月1日將微波消融納入健保給付範圍,適用於3公分以上的肝腫瘤,加上原本健保已給付類似原理的射頻消融(俗稱電燒),消融的應用範圍更加廣泛。
諮詢/徐士哲(臺大醫院內科部主治醫師、臺大癌醫中心醫院及臺大雲林分院兼任主治醫師、臺大醫學院內科兼任講師)
撰稿/張雅雯
所謂腫瘤消融就是利用影像系統導引,把一根根的探針置入腫瘤的內部或附近,透過探針作為媒介,從外部給予能量(例如熱能),以達到破壞腫瘤的目的。相較於手術切除,消融屬於微創介入治療,傷口小、出血少是它的優點。
射頻、微波原理不同 但均以熱能來消融腫瘤
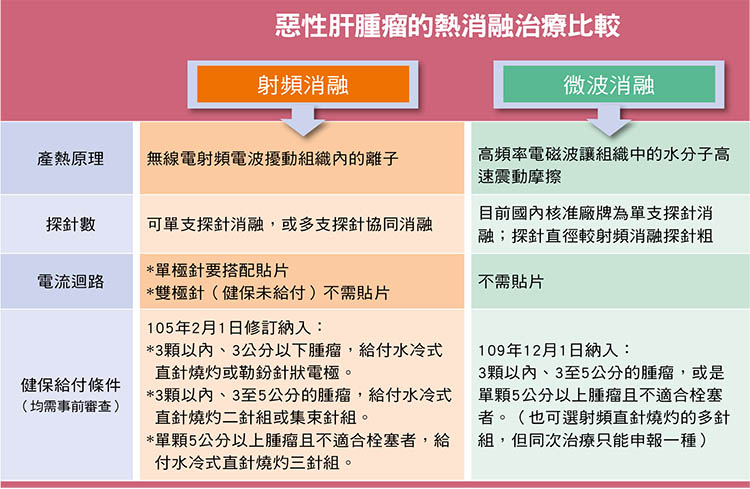
在肝癌治療上,過去最廣泛應用的是射頻消融(Radiofrequency ablation, RFA),即俗稱的電燒,它是利用電極針頭發出的無線電射頻電波,擾動組織內的離子而產生熱能破壞腫瘤組織。臨床資料顯示,3公分以內的肝癌以射頻消融治療,效果與手術切除相當。因此對於早期肝癌患者來說,射頻消融是根除性治療的選項之一。即使是中晚期肝癌患者,消融仍有其輔助性角色在,比如患者有兩顆一大一小的腫瘤,若不適合同時手術切除,可藉由手術切除大顆腫瘤,小顆的腫瘤以射頻消融治療。
至於微波消融(Microwave ablation, MWA)也是以「熱」做為能量,但產熱原理與微波爐類似,是把一種高頻率電磁波導入腫瘤,讓組織中的水分子高速震動,透過分子摩擦產生熱能,造成腫瘤局部凝固性壞死。
微波消融應用於肝腫瘤治療已有近20年的歷史,但舊式微波消融效果較差,實用性不如射頻消融。新一代的微波消融改良探針的設計及頻率,搭配水冷系統,可以在短時間內擴大消融範圍。新一代微波消融的消融範圍可預測性較高,也較不易受到鄰近大血管產生的熱沉效應(heat sink effect,大血管血流導致熱能逸散),因此在肝癌治療上也逐漸佔有一席之地。
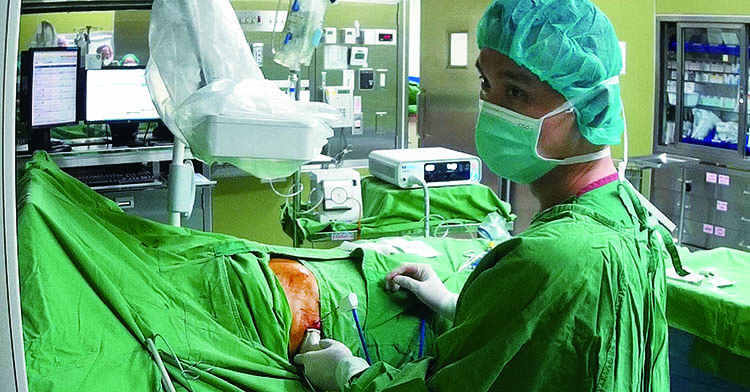
(醫師在超音波導引下替病人進行微波消融治療/圖片:徐士哲醫師提供)
微波消融的優勢
相對於射頻消融,微波消融有幾項優勢:
1. 治療時間較短
若以同樣的消融範圍來比較,微波消融治療的功率更大,可以更快達到高溫,因此治療時間約只需射頻消融的三分之一。操作時間愈短,病患感受到疼痛不適的時間也縮短。
2. 治療範圍更大
同樣用單支探針,微波消融在處理3公分以上的腫瘤也有很好的效果,因此健保將微波消融納入給付,適用3公分以上的肝腫瘤治療。
3. 治療效果較能預測
射頻消融針對病灶燒灼時,未必都能產生近於球體的消融範圍,有時會像長條形,無法完整包覆整個病灶;新型微波消融範圍可預測性高,且消融範圍接近於理想球體。
4. 電流迴路不需搭配貼片
微波消融雖然與射頻消融都是通電產熱,但射頻消融若使用單極探針(monopolar),需要在患者腿部接上貼片,讓發送出能量的主機以及探針產生一個迴路。若治療時間較長,貼片貼附處可能蓄積熱能造成局部皮膚燙傷。
精準影像定位 是消融成功的基礎
當熱能超過60℃以上,就會造成腫瘤或正常組織壞死,因此不論使用射頻消融或微波消融,如何取其優點讓腫瘤被熱能破壞、又能減少正常組織受到熱傷害,除了當下透過影像檢查來監控,更重要的是探針放的位置,因此準確的定位非常關鍵。
最常見也最便利的導引定位工具是超音波,其影像解析度高,也沒有輻射暴露之虞。對醫師來說操作時比較有彈性,可以邊看超音波影像,邊放入探針。但是若腫瘤長在比較深的位置或被腸子及肺部氣體遮住的地方,不易使用超音波觀察,則需搭配電腦斷層導引,為了精確標定腫瘤位置,做電腦斷層時必須施打顯影劑,或於消融術前先進行血管攝影做碘油栓塞(Lipiodol embolization),碘油會滯留在肝癌細胞內,即使不打顯影劑,也能透過電腦斷層看清腫瘤的位置以進行定位。相較於超音波導引,電腦斷層導引需耗用較多時間。
中大型腫瘤也可用多針射頻 或微波消融
針對一顆中大型肝癌(中型指3∼5公分,大型指大於5公分),原則上優先考慮手術切除,但有些患者可能因肝功能異常、年邁或其他原因不適合開刀,經由消融治療仍有機會根除腫瘤。過去若只用一支探針做射頻消融,因為消融範圍大概就是3公分左右,需要多次從不同角度佈置探針來消融腫瘤,以擴大治療範圍。然而重疊消融比較耗時,且有時不易判斷消融範圍是否已經完整。
後來發展出多探針的消融方法,也就是同時採用2支或更多探針插入腫瘤內,可從多點位置協同攻擊。這種方式比單針消融來得有效率,一方面避免單針反覆消融拉長治療時間造成病患疼痛,另一方面多針的方式經過電腦控制輪流供應射頻能源,可均勻且擴大消融範圍,減少藏在縫隙內的癌細胞,增加治療成功的機率。
此外,要提升射頻消融的效能處理較大的腫瘤,除了採用多針,有些醫師的治療手法是將探針置放在腫瘤外圍,不接觸腫瘤,燒灼時可以涵蓋更大範圍。但相對來說病患正常的肝組織也損失較多,故必須考量患者的肝功能。
微波消融因功率很強,透過單支探針可以產生接近多針射頻消融的治療範圍,因此健保就是比照多針射頻消融,增加微波消融這個選項,同樣可用於3公分以上的中大型肝腫瘤。
其他消融方式
1. 冷凍消融藉由溫差讓腫瘤壞死
肝癌消融的方式除了上述的熱消融,其實還有冷凍消融,又稱為氬氦刀冷凍消融 (Cryotherapy),這是把粗細不同的超導探針,在影像系統的導引下,穿刺入腫瘤組織位置後,先釋放出氬氣,讓腫瘤組織間的溫度快速降到零下160∼180℃,使腫瘤組織形成冰球;接著改輸氦氣,讓溫度迅速上升至25℃,藉著降溫回溫的溫差變化讓冰球破裂,同時讓腫瘤組織崩解。此外,冷凍消融也可讓支援腫瘤細胞的血管結凍,造成血管阻塞的效果,讓腫瘤因缺血而進一步壞死。
目前健保尚未給付冷凍消融,臨床上運用在腎癌和肺癌較多,肝癌是因為射頻消融有較多臨床實證,較早就有健保給付,因此要做消融時往往會優先考慮射頻消融。不過肝癌患者的腫瘤位置若靠近血管或膽管匯集處,冷凍消融或許比熱消融更適合,有些文獻分析認為,利用冷凍消融治療鄰近大血管的腫瘤,對於鄰近器官組織的影響不像熱消融那麼多。
然而冷凍消融同樣要注意探針的位置,因為冷凍讓組織內結冰的冰球,不只是在原定位處而已,而會往後延伸,因此必須要思考探針怎麼放,才不會讓冰球傷到不想傷到的部位。此外,也有文獻指出冷凍消融潛在的後遺症,包括病患做完冷凍消融後,可能釋放出發炎因子,導致患者產生嚴重的發炎反應;或是冰球若破裂在肝的表面,可能導致肝的包膜破裂,增加出血風險。
2.奈米刀需全身麻醉在手術室進行
有些腫瘤生長的位置較刁鑽,不論冷熱消融均無法妥善處理,奈米刀—不可逆電穿孔治療(Irreversible electroporation, IRE)被視為有治療的潛力,它是利用一根根細如琴弦的探針,插入欲擊殺的腫瘤區域,透過釋放高壓電流在腫瘤細胞膜上形成大量奈米大小的穿孔。
透過高壓電流讓細胞穿孔造成細胞凋亡,比較不會破壞腫瘤鄰近膽管或血管管壁的纖維組織。這些纖維組織由蛋白質組成,而熱消融或冷凍消融都會造成蛋白質凝結變性,高壓電就沒有這個問題。因為奈米刀能量不會傳遞到要消融的區域之外,更不會危及鄰近消融區的膽管或血管組織,利用這個特性可以用來治療不適合熱消融或冷凍消融的部位或器官,最具代表性的就是胰臟癌。即使奈米刀無法完全消融掉胰臟腫瘤,也能做到把腫瘤體積縮小。目前奈米刀在肝、腎、肺及攝護腺腫瘤,均有臨床使用報告,不過台灣僅有少數醫師施行,健保也沒有給付。
奈米刀治療時會造成病人肌肉因電擊而劇烈抽動,嚴重時會造成肌肉溶解而致腎衰竭,所以病患必須插管接受全身麻醉;且每次的電擊必須配合心跳同步進行,也有可能引起心律不整及高血壓,因此必須衡量病患是否有相關風險。
熱消融仍是主流 微波未來可能取代射頻
綜合來看,在肝腫瘤消融此一領域,射頻消融的治療角色早已受到肯定;微波消融則是類似的做法但更有效率,也已經被納入歐洲肝癌治療指引中。治療時間短且消融範圍可預測性高是微波消融最大的優勢,當累積更多臨床使用經驗,未來或有機會取代射頻消融。至於冷凍消融治療肝癌臨床應用尚不普遍;奈米刀雖然可以避免傷及周遭組織,但最大受限是必須全身麻醉執行,較不易普及。
資料來源:https://www.liver.org.tw/journalView.php?cat=69&sid=972&page=1

